|
不同稀释用水对猪精液常温保存效果的影响
赵文婧 1,2,许春荣 3,刘 娟 1,2,张争光 1,2,赵欢欢 1,2,秦?程 1,2,彭夏云 4,粱金逢 4 *,文信旺 5 *,胡传活 1,2 *
(1.广西大学动物科学技术学院,广西 南宁 530004;2.广西畜禽繁育与疾病防控重点实验室,广西 南宁 530004;3.广西畜禽品种改良站,广西 南宁 530001;4.广西农业职业技术大学畜牧研究院,广西 南宁 530001;5.广西水牛研究所,广西 南宁 530001)
猪人工授精(Artificial insemination,AI)作为提高生猪生产效率最佳的繁殖技术,在猪的繁殖中得到了广泛应用。17℃保存精子的技术因其成本低廉,操作简便,繁殖效率高而被广泛使用。在猪精液的常温保存中,除了要考虑猪精液本身质量、基础营养液和抗生素等因素外,溶解稀释剂所用水也是需要考虑的主要因素。而目前养猪生产实际中使用去离子水较多,季本林等比较了自来水、自制双蒸水、天然降水、井水配制稀释剂保存猪精液后检测精子的存活时间、受胎率、产仔数等指标,结果显示各组差异不显著。黄志秋的研究表明,高山矿泉水和蒸馏水保存的精子存活时间最长,目前关于不同稀释用水对猪精子常温保存效果的影响未有定论,也是困扰养猪生产中的一个关键问题。
因此,本试验选用了4种畜牧生产常用水用于溶解稀释剂,探究这4种稀释用水对猪精液常温保存的效果,以期筛选出保存效果较好的猪精液稀释用水,为优化猪精液常温保存方案提供参考依据。
1
材料与方法
1.1 试验材料
4种稀释用水中,超纯水取自默克Milli-Q Direct-Q 纯水仪、2种商品化矿泉水和1种商品化纯净水均购自超市,分别命名为A、B、C、D组,购买后放置4℃保存备用。精子活体染色试剂盒(伊红-苯胺黑法)、考马斯蓝R250购自索莱宝生物公司,DNA碎片指数(DNA-fragmetation-index,DFI)试剂盒购自深圳市博锐德生物科技有限公司,活性氧(Reactive oxygen species,ROS)、线粒体膜电位(Mitochondrial membrane potential,MMP)检测试剂盒购自碧云天生物技术公司。
1.2 精液的采集、稀释和保存
手握法采集广西科达畜禽改良有限责任公司6头体况相近的体型健壮、无生殖疾病史的隆林黑猪精液,检测精子总活力>80%用于后续试验。取到精液后用不同水配制的稀释剂进行稀释,将精子密度调整为1×106个/mL。在室温下平衡1 h后,用纱布包裹,放入电子冷暖箱中于17℃下保存,每隔6~10 h轻轻晃动1次。
1.3 检测指标及方法
1.3.1 精子活力的测定
在精液保存的8 d中,每24 h取出样品1 mL,在培养箱中37℃下预热15 min,上下颠倒混匀后取10 μL加入精子计数池中,使用计算机辅助精子分析系统(Computer-aided sperm analysis,CASA)检测精子活力,每个样品重复3次。
1.3.2 精子活率的测定
在精液保存第2、4、6、8天,采用伊红-苯胺黑法对精子活率进行检测,即:将精子1 000 r/min离心5 min,弃上清并加入磷酸盐缓冲液(Phosphate buffer saline,PBS),混匀后再次1 000 r/min离心 5min,重复3次后,根据精子活体染色试剂盒说明书染色后涂片,在光学显微镜400倍下观察,每个样本至少计数200条精子,重复3次。死精子头部被染成红色或暗粉红色,活精子头部呈白色,如图1,a表示死精子,b表示活精子。精子活率=头部白色精子数/计数的总精子数×100%
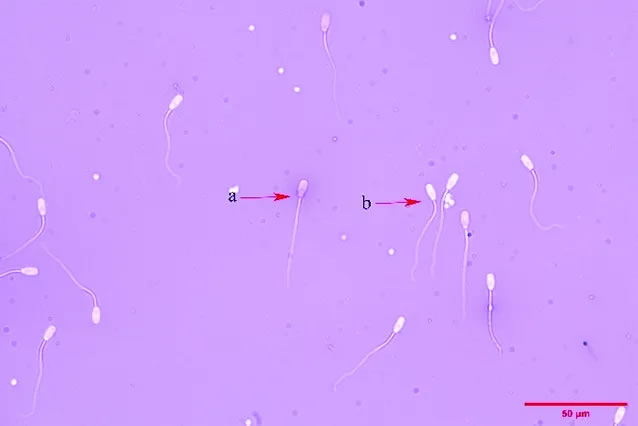
图1 猪精子活率的检测示例图
1.3.3 精子质膜和顶体完整率的测定
在猪精液保存第2、4、6、8天,用低渗肿胀试验评价精子质膜的完整性,具体操作流程参照谢运法等的方法。简而言之,取1 mL精液,1 000 r/min离心5 min,弃上清并加入PBS洗3遍后,取100 μL精子加入1 mL果糖-柠檬酸钠低渗溶液,37℃下孵育30 min后涂片,用光学显微镜观察尾巴卷曲的精子百分比,如图2,a表示质膜完整的猪精子,b表示质膜不完整的猪精子。每个样本至少计数200条精子,重复3次。精子质膜完整率=尾巴弯曲精子数/计数的总精子数×100%
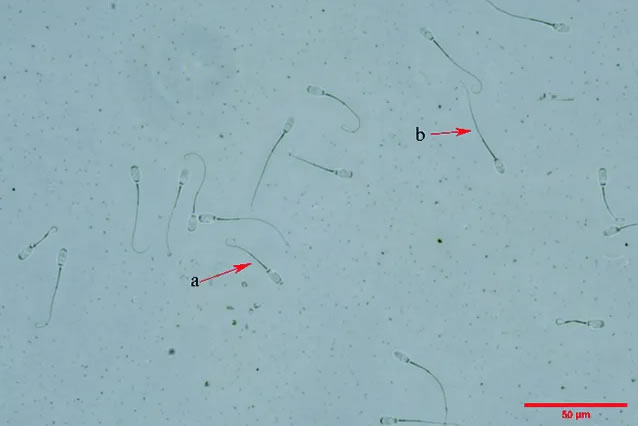
图2 猪精子质膜完整率检测示例图
相同时间下,用考马斯亮蓝染色法评估精子顶体完整率,参照谢运法等的方法,将1 mL精液以1 000 r/min离心5 min,弃上清并加入PBS洗3遍后,加入装有1mL 4%多聚甲醛的EP管中,固定30 min,2 200 r/min离心5 min,弃掉上清液后加入PBS洗1次,加100 μL PBS,混匀制成悬液,取10 μL涂片,自然晾干。把晾干后的载玻片放入37℃预热的考马斯亮蓝染色缸中,染色5 min,然后取出用纯水缓缓冲洗载玻片2 min,置于染色架上自然晾干。光学显微镜下观察顶体完整性(顶体完整的精子顶体呈表面光滑的均匀蓝色),重复3次。如图3,a表示顶体完整的猪精子,b表示顶体不完整猪精子。精子顶体完整率=顶体完整精子数/计数的总精子数×100%
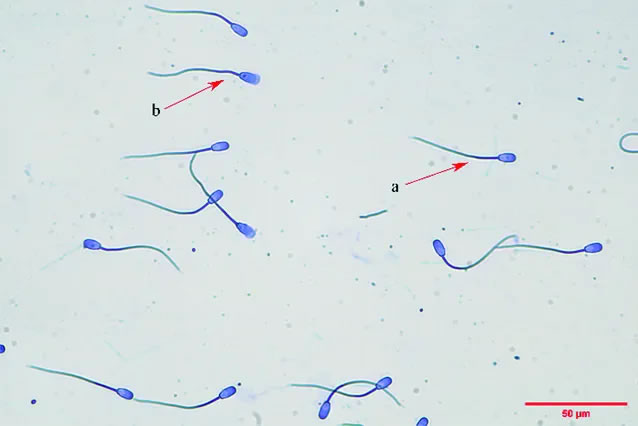
图3 猪精子顶体完整率的检测示例图
1.3.4 精子DFI的测定
在猪精液保存的第2、4、6、8天,取1 mL精液用PBS洗3遍,根据精子DFI染色试剂盒说明书进行操作,涂片后用荧光显微镜观察拍照。用image j分析每张照片的红绿荧光的平均荧光强度。DFI%=红光的平均荧光强度/(红光+绿光)的平均荧光强度1.3.5 精子MMP的测定
在猪精液保存的第2、4、6、8天,取1 mL精液,1 000 r/min离心5 min,弃上清并加入PBS洗涤3次后,根据MMP检测试剂盒说明书进行操作,涂片后用荧光显微镜观察拍照,用Image j分析每张照片的红绿荧光的平均荧光强度。线粒体膜电位=红光的平均荧光强度/绿光的平均荧光强度1.3.6 精子ROS水平的检测
在精液保存的第2、4、6、8天,取1 mL精液,1 000r/min离心5 min,弃上清并加入PBS洗涤3次后,根据ROS检测试剂盒说明书进行操作。涂片后用荧光显微镜观察拍照,用Image j分析每张照片的绿色荧光的平均荧光强度。
1.4 数据分析
运用 SPSS23软件对试验数据进行单因素方差分析,数据结果用平均数±标准差表示,P<0.05表示差异显著。用Prism 8.0.2软件进行作图分析。
2
结果与分析
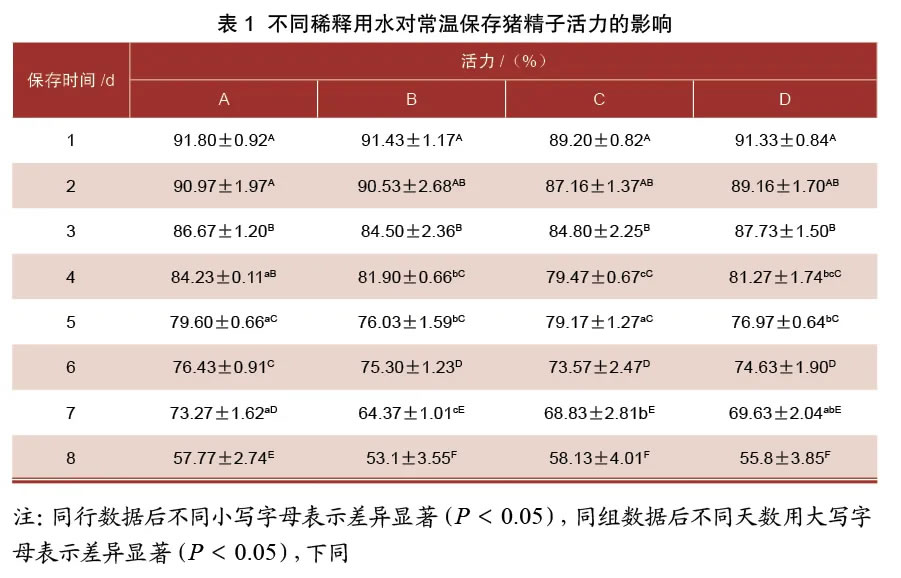
2.1 不同稀释用水对常温保存猪精子活力的影响由表1可知,不同水和不同保存天数均对猪精子活力有显著影响,在精液保存第3天猪精子活力显著下降(P<0.05)。在保存第1、2、3、6、8天,各组精子活力之间差异不显著(P>0.05)。保存到第4天时,A组精子活力显著高于其他3组(P<0.05)。A组和C组在保存第5天时精子活力显著高于B组和D组(P<0.05)。保存第7天时,A组精子活力显著高于B组和C组(P<0.05),与D组差异不显著(P>0.05)。
2.2 不同稀释用水对常温保存猪精子活率的影响由表2可知,在猪精液常温保存的第4~6天各组精子活率显著下降(P<0.05)。在第2天、第4天、第6天,A组的猪精子活率显著高于C组和D组(P<0.05),与B组没有显著差异(P>0.05)。在第8天,各组猪精子活率之间没有显著差异(P>0.05)。
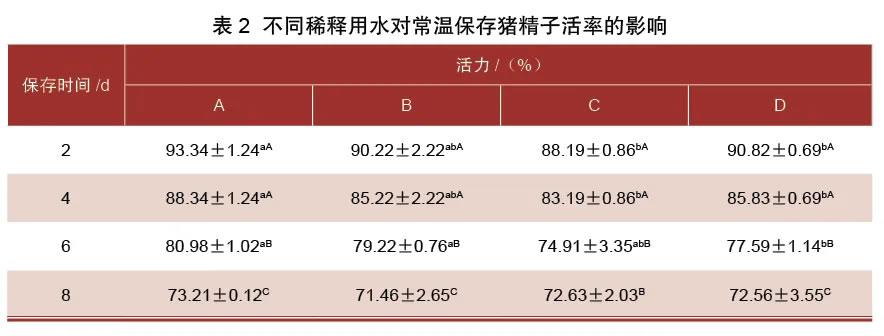
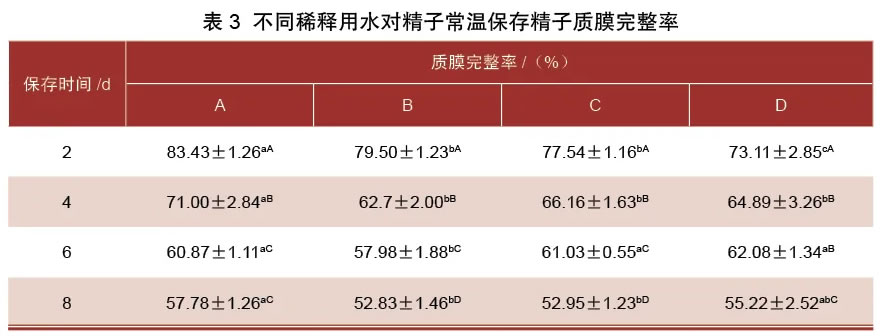
2.3不同稀释用水对常温保存猪精子质膜完整率的影响由表3可知,在猪精液常温保存第2~4天、第4~8天,各组质膜完整率显著下降(P<0.05)。在第2天、第4天,A组质膜完整率显著高于其他3组(P<0.05)。保存第6 天时,B组质膜完整率较其他3组低(P<0.05)。
2.4 不同稀释用水对常温保存猪精子顶体完整率的影响如图4所示,在保存8 d中,各组精子顶体完整率没有显著差异(P>0.05),但随着保存时间延长都逐渐降低。
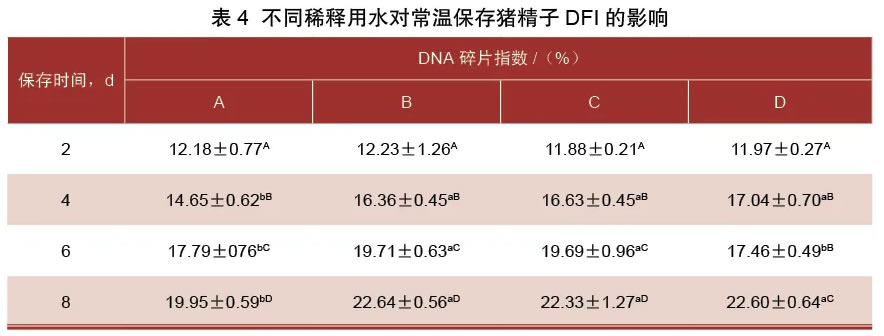
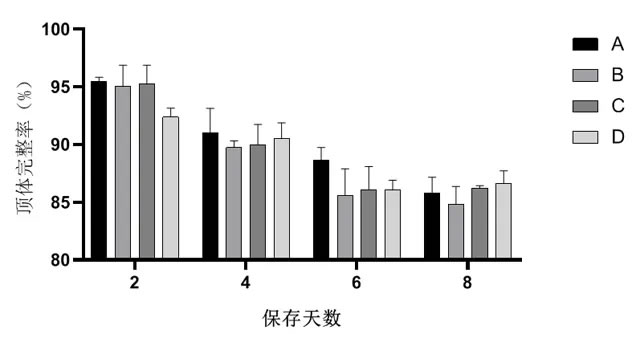
图4不同稀释用水对常温保存精子顶体完整率的影响
2.5不同稀释用水对常温保存猪精子DFI的影响
由表4可知,各组猪精子DFI在保存2~4 d、4~8 d,呈现显著上升趋势(P<0.05)。保存第2 d,各组精子DFI差异不显著(P>0.05)。保存第4天,A组DFI显著低于其他3组。保存第6天,B组、C组的DFI显著高于A组、D组(P<0.05)。保存第8天时,A组显著低于其他3组(P<0.05)。
2.6 不同稀释用水对常温保存猪精子MMP的影响由图5可知,随着保存时间的延长,猪精子MMP逐渐下降。在保存第2天,各组猪精子MMP差异不显著(P>0.05)。保存第4天,D组MMP明显高于B组和C组(P<0.05)。保存第6天,A组和D组MMP显著高于B组(P<0.05),与C组差异不明显(P>0.05)。
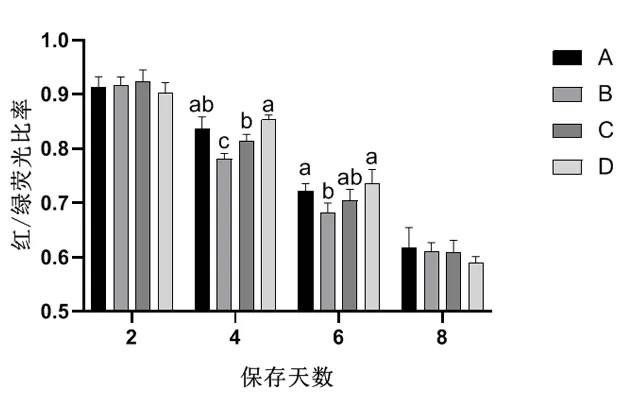
图5 不同稀释用水对常温保存猪精子MMP的影响
2.7 不同稀释用水对常温保存猪精子ROS的影响由图6可知,在保存第2、6天,A组与C组、D组没有显著差异(P>0.05),显著低于B组(P<0.05)。保存第4天时,A组精子ROS水平显著低于其他3组(P<0.05)。
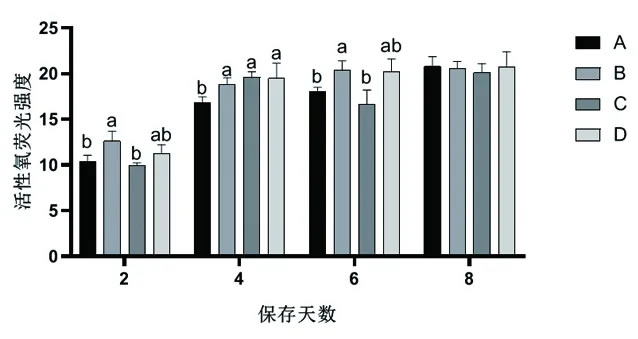
图6 不同稀释用水对常温保存猪精子ROS水平的影响
3
讨论
猪精液常温保存技术至关重要,直接决定猪人工授精的成败,而决定保存效果的主要因素有水质、稀释剂和保存温度等,稀释用水配制的稀释剂对猪精液常温保存的影响至今还未有定论,为了筛选出精液保存效果较好的稀释用水,笔者选用了畜牧生产中常用的4种水进行了活力、活率、质膜和顶体完整率、DFI、MMP和ROS水平的检测。
种公畜禽的精液质量直接决定母畜的受精率、产仔率或孵化率,是影响畜禽生产繁殖效益的重要因素。精子活力、活率、质膜完整性以及顶体完整性是评价精液品质重要的评价指标。本研究结果显示,在保存精液前2 d,各组的精子活力没有显著差异;在保存第4天,A组精子活力、活率、质膜完整率均显著高于其他3组,但顶体完整率各组没有明显差异。精子活力、活率、质膜完整性以及顶体完整性在保存2~4 d显著降低,说明在精液保存过程中猪精子质量持续下降,可能是产生ROS超过了天然抗氧化防御能力,导致精子氧化应激,从而对精子产生有害作用。本试验的结果表明,与其他3组相比,A组稀释用水对常温保存第4天精子的活力、活率和质膜完整率有更好的保持作用,说明其对精子的常温保存效果更好。
精子获能后,发生胞吐作用并释放其顶体内容物,发生顶体反应,促进精子和卵子结合。在本试验中,顶体完整性随着保存时间的延长而降低,但各组之间并没有明显差异,其原因有待进一步探索。
公猪精液长期常温保存中ROS过量积累,通过膜多不饱和脂肪酸抑制精子功能,并导致精子核DNA损伤。本试验中,在保存第2~4天,不同稀释用水在猪精液常温保存中精子DNA损伤较前2d显著增加。在保存第4天时,A组DFI显著低于其他3组,另一种可能的原因是B组和C组稀释用水中含有铁、砷、钒等重金属离子。LI等研究表明,长期接触砷会破坏睾丸的形态和功能,阻碍精子的产生,降低精子活力,改变精子的形态和功能,从而对精子DNA产生损伤。结合ROS结果来看,保存第4天时,A组ROS水平显著低于其他3组,说明A组稀释用水可以减少ROS的积累,缓解氧化应激,降低对精子DNA的完整性的损害,有利于精子常温保存的质量。
AGNIHOTRI等的研究表明,线粒体的功能状态可以全局反映精子的功能,并可以通过MMP变化来评价。本试验结果显示,精子常温保存4~6 d,A组和D组MMP显著高于B组和C组,且A组的保存效果比D组的更好。从本研究的结果来看,与其他3组相比,A组稀释用水可以通过改善精子的MMP来保护精子线粒体功能,进而改善精子在常温保存过程中的质量和功能。
4
结论
综上所述,在猪精子保存4 d内,A组稀释用水对常温保存猪精子活力、活率和质膜完整率有显著的改善作用。此外,A组稀释用水还可以通过缓解猪精子DNA损伤和氧化应激,保护线粒体功能,进而改善精子质量和功能。
|
